|
MedDRA®用語選択:
|
©本資料の著作権はICH事務局(IFPMA内)にある。 出典を明示することで、本資料の複写・引用は可能であるが、著作権者の事前の了解なしに、本資料の内容を営利目的で電子媒体を含むいかなる文書に利用することは許されない。 IFPMA Chemin Louis-Dunant, 15 P.O. Box 195 1211 Geneva 20 Switzerland Tel: +41 (22) 338 32 00 Fax: +41 (22) 338 32 99 http://www.ifpma.org/ 本資料の日本語版はICHのPTC-WGの日本国内メンバーの協 力を得て、JMO事業部が翻訳したものである。 |
ICH国際医薬用語集(MedDRA)は、ヒトに用いられる医療用製品に関する規制情報を共有するという特定の用途を目的に作成されたものである。しかし、報告された症状、徴候、疾患などに対する用語選択に際して、ユーザーの利用に一貫性がなければ、MedDRAを使用したとしても、コーディングされたデータの交換に調和ある効果は期待できない。
本文書「MedDRA Term Selection: Points to Consider」はICHの活動の一環としてMedDRAユーザーのために作成されたガイドであり、ICHの運営委員会の指示によって設けられたワーキンググループにより作成およびメンテナンスが行われている。MedDRAの改訂に伴って更新される予定でありMedDRAに付随する文書である。
1.1 本文書の目的
本文書の目的は、用語選択の正確性と一貫性を向上させることにある。
MedDRAを利用する組織において、用語選択の方法、品質保証の手順をそれぞれのコーディングガイドラインとして文書化することが推奨され、その基本的考え方は本文書「Term Selection: Points to Consider」と一致している必要がある。
用語選択の一貫性は、MedDRAを用いたデータを世界的に共有する際に医学的な正確性を促進することとなる。同時にこのことは、学会、民間企業および規制当局などの間で共有される安全性データの共通理解を促進するものになると思われる。本文書は、医療従事者や研究者をはじめ、規制対象の製薬企業業界*以外の関連団体が使用する可能性もある。 本文書は企業と規制当局双方にとって用語選択のためのアドバイスを提供することを意図して作成されたものである。例示は、すべての地域の規制状況あるいは実情を反映したものではないかもしれない。本文書は、各規制当局への報告の必要条件やデータベース関連事項を解説することを目的としたものではない。今後、MedDRA使用の経験が増え、また、MedDRAが改訂されるに従い、内容の変更が行われるであろう。 *原文はregulated biopharmaceutical industry
1.2 MedDRAの目的
本書は副作用/有害事象(AR/AE*)、医療機器関連の事象、製品品質問題、投薬過誤、医療歴、社会的履歴、臨床検査、適応症に関する用語選択について記述している。MedDRAの構造は上記のような報告を医学的に意味のあるグループ化を行い、安全性データの分析を促進することを可能とする。また、MedDRAはAR/AEデータを報告書の形式(表、ラインリストなど)にまとめるために、あるいは同様なAR/AEの頻度計算、さらに、適応症、臨床検査、医学的、社会的履歴などのAR/AEに関連したデータの抽出や分析にも利用できる。
*本書ではAR/AE(adverse reactions/adverse events)という表記を用いている
1.3 本文書の利用法
本文書がすべての用語選択の状況に対応できるものではない。本文書の利用にあたっては医学的な判断および安全性情報の取扱いに関する一般的な知識が必要である。
本文書はMedDRAのトレーニングに代わるものではない。ユーザーは前もってMedDRAの内容および構造についての知識を持っていることが必須である。
MedDRA用語の最適な選択のために「ICH国際医薬用語集(MedDRA)手引き書」(付録4.2項参照)を参照されたい。
1.4 好ましい選択肢
用語選択に幾つかの可能性がある例では、好ましい選択肢(Preferred option)を示している。
「好ましい選択肢」は、ユーザーがその選択肢を用いることを強制するものではない。
しかし、同一組織内では、どの選択肢を採用するかは統一したものであることが必要である。
1.5 MedDRAブラウザー
MSSOとJMOは用語検索、およびMedDRAの内容閲覧のための2種類のブラウザー(デスクトップ型、Web オンライン型)を提供している。(付録4.2項参照)これらのツールはユーザーにとって用語選択の有用な道具となるであろう。
2.1 原データの質
オリジナル情報の質はデータ出力に直接影響する。不明瞭なデータ、矛盾したデータ、あるいは不可解なデータについては、それらの明確化を報告者に求めることが必須である。情報の明確化ができなかった場合には、本文書の「項目3.4 矛盾/不明瞭/曖昧な情報」を参照されたい。
2.2 品質保証
一貫した用語選択を推進するために、各組織は用語選択の方法、品質保証の手順をそれぞれのコーディングガイドラインとして文書化することが推奨されており、その基本的考え方は本文書と一致している必要がある。
データ収集のための様式を慎重にデザインするとともに、臨床試験担当医師、医薬情報担当者など、データ収集過程に携わる者に対して教育を行うことによって、より明確なデータを収集することが可能になる。
用語選択結果は適任者(医学的背景あるいは関連する経験があり、かつ、MedDRA使用の訓練を受けた者)によってレビューされる必要がある。
オートエンコーダーなどのITツールによる用語選択の結果が、報告された情報を十分に反映し、かつ、医学的に意味をなすものであるために、人による最終チェックが必要である。
2.3 MedDRAを変更してはならない
MedDRAは標準用語集であり、用語の階層構造はあらかじめ決められている。
ユーザーはプライマリーSOCの変更など便宜的な構造上の変更は行ってはならない。
若しそのようなことが行われればMedDRAの標準用語集としての品質を危険にさらすこととなる。
用語が階層構造上で不適切に分類されていると考えた場合には、変更要請をMSSOに提出すべきである。
例示

2.4 常にLLTを選択する
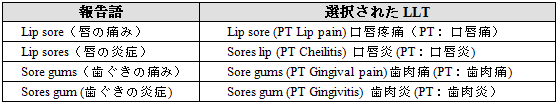
報告された情報を最も正確に反映する「下層語(LLT)」を選択すべきである。
幾つかのLLTは非常に特異性が高いものがあり、それらの用語選択に際しては十分な注意が必要である。
• 報告語の中のアルファベット一文字の有無によって用語の意味が異なり、最終の用語選択に影響することがある。
例示
• 性別を特定した用語
通常、MedDRAでは、人の集団に関する修飾語(性別、年齢など)は除外されているが、性別が重要な意味を持つ場合には、例外的に性別を特定した用語が収載されている。
例示

組織内の用語選択ガイドには、性別を特定した用語が重要な場合の例を示すべきである。
また、MedDRAでコードされたデータと性別を特定した用語を持たない他の用語集でコードされたデータと比較する場合には注意が必要である。

• 術後および処置後を特定した用語
MedDRA には、術後あるいは処置後を特定した用語が収載されているので、最も適切な用語を選択するべきである。
例示

• 新規追加用語
新バージョンを使うことにより、新規に追加されたより詳細なLLTを選択することが可能な場合がある(付録4.2項参照)。
2.5 カレントLLTを選択する
ノンカレントのLLTを選択してはいけない。
JMO注:ここで意味するノンカレントは英語LLTに対するカレンシーフラグである
2.6 用語の追加要請
各組織が独自の解決法を作成することによって、MedDRAの不備に対処することは適切ではない。
報告された医学的概念がMedDRAの最新版で的確に表現されていない場合は、MSSOに対して変更要請する。
例示

2.7 医学的判断の必要性
完全に一致する用語は見つからないが、該当する医学的概念がMedDRA中の現存用語で適切に表現されていると考えられる場合には、医学的判断により用語を選択すべきである。
例示
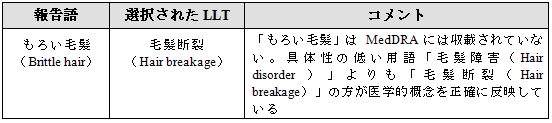
2.8 複数の用語の選択
単一のMedDRA用語では特定の医学的概念が表現できない場合には、新規用語の追加要請の手順に従い用語追加を考慮すべきである(項目2.6参照)。
新用語が追加されるまでは、単一あるいは複数の現行用語を選択するが、このような場合には一貫性のある方法が用いられるべきであり、データ検索、分析および報告に対する影響を慎重に考慮すべきである。
場合によっては、報告された情報を表現するために2つ以上の用語を選択することが適切である。1語だけを選択した場合、報告された情報の特異性が失われることがある。一方2語以上を選択した場合、AEの件数が冗長となる可能性がある。用語選択の手順を決め、それを記録に残しておくべきである。
例示

2.9 階層構造の確認
LLTを選択する際は、そのLLTが報告語の意味を正確に反映しているか、上層(PTおよびそれ以上のHLT,HLGT,およびSOC)へのリンクを確認すること。
2.10 報告された情報をすべて用語選択するが、情報の追加は行わない
医薬品との関連性が認められているかどうかとは無関係に、報告されたすべてのAR/AEに対して用語を選択するべきである。さらに医療機器関連の事象、製品品質問題、投薬過誤、医療歴、社会的履歴、臨床検査、適応症についても適切に用語選択を行うこと。
診断が特徴的な徴候・症状とともに報告された場合には、診断に対してのみ用語選択することが推奨される(詳細と例示は項目3.1を参照)。
用語選択の過程で、報告された情報を削除してはならない。同様に徴候・症状のみが報告された場合に診断名を選択してはならない。それは情報を追加したことになる。
例示

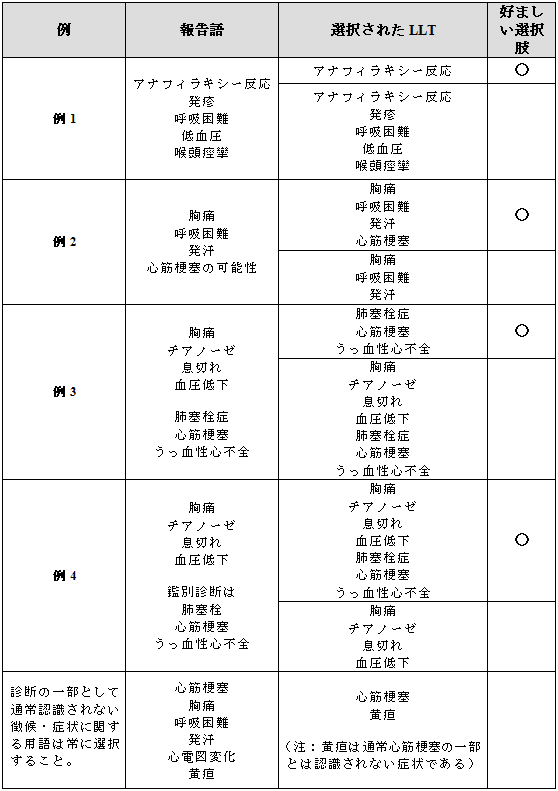
3.1 確定診断、暫定的診断および徴候・症状
下記の表は診断または暫定的診断が徴候・症状とともに報告された場合と、徴候・症状が報告されなかった場合の用語選択のポイントを示している。
例示は後半の表に示してある。
暫定的診断は“疑い(suspicion of)”、“可能性あり(probable)”、“推定される(presumed)”、“らしい(likely)”、“除外(rule out)”、“疑問の余地あり(questionable )”あるいは“鑑別診断(differential)”などの表現で報告されることがある。

例示と好ましい選択肢
3.2 死亡およびその他の転帰
死亡、障害、入院などは安全性報告の関連では転帰と考えられ、通常AR/AEとは見なされない。転帰はAR/AE情報とは異なる方法(データフィールド)に記録される。
唯一報告された情報が「転帰」の場合、あるいは転帰が臨床的に重要な情報である場合には、転帰の内容を表す用語を選択すべきである(自殺、自傷に関する報告は項目3.3を参照)。
3.2.1 副作用/有害事象に伴う死亡
死亡は転帰であり通常AR/AEとは見なされない。AR/AEが死亡とともに報告された場合には、報告された各AR/AEに対して用語を選択する。致命的転帰(死亡)は適切なデータフィールドに入力する。
例示

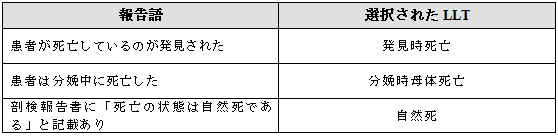
3.2.2 死亡が唯一の情報
唯一報告された情報が「死亡」の場合は、死亡を表す最も具体的な用語を選択する。死亡の状況が報告者によって特定されていない限り死亡の状況を推測すべきではない。
死亡に関する用語はHLGT「致命的転帰」にリンクしている。
例示
3.2.3 重要な臨床情報を含む死亡用語
重要な臨床情報を含んでいる死亡に関する用語は報告されたAR/AEとともに用語選択すべきである。
例示
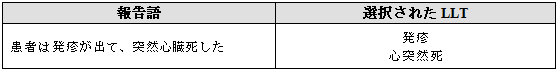
3.2.4 その他の転帰(死亡以外)
入院、障害、その他の転帰などは通常AR/AEとは見なされない。
例示

唯一報告された情報が「転帰」の場合は、転帰を表す最も具体的な既存用語を選択する。
例示

3.3 自殺および自傷
適切なデータ検索と分析のためには、「自殺企図」、「自殺既遂」、「自傷」などの報告語の正確で一貫性のある用語選択が必要である。報告された傷害の動機が不明な場合にはより詳細な情報の入手を試みるべきである。
3.3.1 過量投与
「過量投与(企図的過量投与を含む)」を「自殺企図」であると推測すべきではない。「過量投与」のみを表す最も適切な用語を選択する(項目3.17参照)。
3.3.2 自傷
「自殺」または「自殺企図」にはふれていない「自傷」の報告は「自傷」のみを表す最も適切な用語を選択すべきである
例示

3.3.3 自殺既遂
「自殺企図」が死亡に至った場合には、「自殺企図」のみではなく「転帰」を反映する用語を選択する。

3.4 矛盾/不明瞭/曖昧な情報
入手した情報が矛盾している場合や不明瞭あるいは曖昧な場合には、適切なデータ検索を可能とするための用語の選択が困難になることもある。そのような場合は、より明確な情報を入手するよう試みるべきである。
明確な情報が得られなかった場合には、以下の例に示す用語選択が可能である(項目3.4.1から3.4.3参照)。
例示

例示
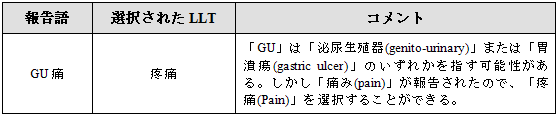
曖昧な情報が報告された場合には、より詳細な情報を入手するよう努めるべきである。詳細な情報が入手できない場合には、報告された事象を反映する非特異的なLLTを選択する。
例示

3.5 組合せ用語
組み合わせ用語とは、単一の医学的概念を表す用語に、病態生理学的あるいは病因学的に重要な情報を表すための医学的用語が付加されたものであり、下記の例に示すような国際的に認められた明確な医学的概念を表すものである。
例示

報告されたAR/AEによっては組み合わせ用語が選択される場合がある(例:ある状態に起因する別な状態)。下記の点に留意すること(医学的判断が求められる)。
3.5.1 診断と徴候・症状
診断と特徴的な徴候・症状が報告された場合には、診断を表す用語を選択する(項目3.1参照)。この例では組み合わせ用語は不要である。
例示
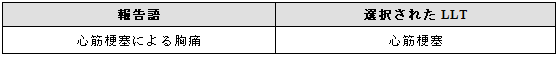
3.5.2 組合せの一方が、より詳細な状況を表す場合
二つの状態が組み合わされて報告され、一方がより詳細である場合には詳細な内容に対する用語を選択する。
例示
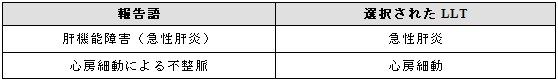
3.5.3 組合せ概念を表すMedDRA用語がある場合
二つの状態が組み合わせで報告され、それを表す単一のMedDRA用語がある場合には、その用語を選択する。
例示
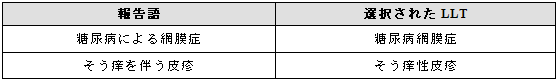
3.5.4 複数のMedDRA用語の選択が良い場合
報告されたAR/AEを分割することで、より多くの臨床情報が得られる場合には、複数の用語を選択する。
例示
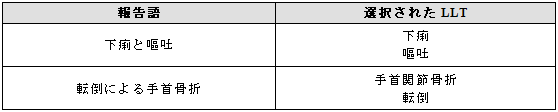
報告語を分割する際に入手した情報が失われないよう医学的判断を用いるべきである。選択したMedDRA用語が報告された情報に対して適切であるかどうか、常にMedDRAの階層構造(上位語)を確認すべきである。
例示

3.5.5 既存の医学的状態と共に報告された事象
ある事象が変化のない既存状態と共に報告され、その組み合わせを適切に表すMedDRA用語がない場合は、事象を表す用語のみを選択する(項目3.9既存の状態の変化参照)。
例示

3.6.1 年齢と事象を特定したMedDRA用語がある場合
例示

3.6.2 年齢と事象を特定したMedDRA用語がない場合
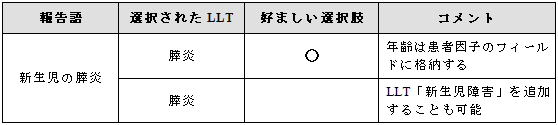
年齢群と事象を特定した用語がない場合には、好ましい選択肢は事象を示す用語を選択する
ことである。年齢は患者因子のフィールドに格納すること。
あるいは、年齢と事象を示す用語を個々に
例示
3.7.1 身体部位と事象を特定したMedDRA用語がある場合
例示

3.7.2 身体部位と事象を特定したMedDRA用語がない場合
身体部位のみが特定されている用語より、事象を表す用語を選択する。言い換えると事象に関する情報は一般的に優先される。
例示

しかし、医学的な判断が必要とされ、場合によっては下記の事例のように身体部位が優先される場合もある。
例示

3.7.3 複数の身体部位に発現した事象
同じ有害事象が複数の身体部位で報告され、それらのLLTが同一のPTにリンクする場合は、その有害事象を最も正確に反映する単一のLLTを選択する。言い換えると事象の情報が優先される。
例示

JMO注)国内の行政指導では個別LLTの報告が求められている
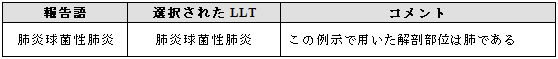
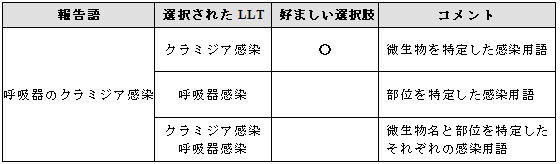
3.8.1 MedDRA用語に微生物名と感染部位を含む用語がある場合
例示
3.8.2 MedDRA用語に微生物名と感染部位を含む用語がない場合
好ましい選択肢は微生物名を特定した感染用語を選択することである。
他の選択肢として、解剖学的部位を表す用語を選択すること、また、微生物名を特定した感染用語と解剖学的部位の複数の用語を選択することも可能である。
各組織は、製品の特性について考慮して、最も適したオプションを選択すべきである。
例示
3.9 既存状態の変化
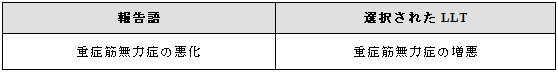
既存の医学的状態の変化、特に状態が悪化または進行した場合はAR/AEとして扱うことができる(3.5.5および3.21項参照)。

変化した状態を正確に反映する用語があれば、選択する。
例示
そのような用語がない場合は、下記のようなオプションを考慮する(データベースの制約にも留意すること)
Ø オプション1:既存の状態を表す用語を選択し、変化した内容は一貫性を持った方法で記録する(文章記述、データ収集様式のチェックボックスなど)。
Ø オプション2:既存の状態を表す用語および追加用語として状態の変化を表す用語(例えば、LLT「状態悪化」、LLT「疾患進行 」)を選択する。
例示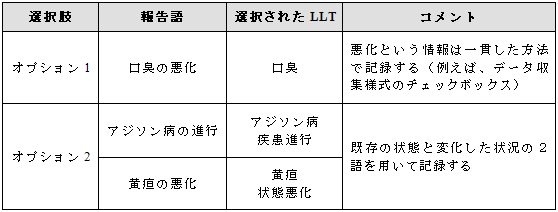
3.10 妊娠中、授乳中の曝露
最も適切に状態を表す用語を選択する。先ず、有害事象が観察されたのが母親か子供/胎児なのかを明らかにする必要がある。
Ø 患者が薬剤服用中に妊娠した
妊娠は通常有害事象とは考えない。しかし、組織によっては、それらの情報をデータベースに保存したいと考える場合がある。
例示

Ø 妊娠した患者が服薬中に有害事象を経験した
例示
3.10.2 子供・胎児での事象
薬剤曝露のタイプと有害事象の用語を選定する。
例示

3.11 先天性用語
MedDRAでの「先天性(congenital)」の定義は、「遺伝的に発現しても、子宮内で生じても、出生時に呈するすべての状態」を言う(「MedDRA手引き書バージョン14.1」参照)。
3.11.1 先天性という状態
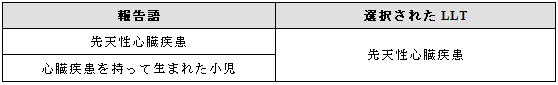
報告者がその状態を先天性であると報告した場合、あるいはその状態が出生時の児に認められたことが医学的判断から明らかな場合には、SOC「先天性、家族性および遺伝性障害」にリンクする用語を用いるべきである。
例示
3.11.2 先天性でない/出生時にみられていない状態
状態が先天性と記述されていない、または出生時に見られていない場合には、先天性と特定されない用語を選択する。先天性と特定されない用語がMedDRAにない場合には後天性の用語を選択する。

3.12 新生物
新生物には多彩なタイプがあるため、全ての状況に対応するガイドを提供することは困難である。しかし、MedDRAの手引き書には新生物およびその関連用語の配置と利用が記述されている。
下記のことに留意する。

報告された新生物のタイプが明確でない場合には、報告者に明確化を求めることを考慮すべきである。難解な、あるいは特殊な新生物に関連する用語を選択する場合には、医学専門家の意見を聴くべきである。
3.12.1 悪性度を推測しない
報告者によって悪性と明示されている場合のみ悪性新生物(癌)に関する用語を選択する。
腫瘍(tumor)との報告に対して、明確な悪性度が示されていない限り「癌(cancer、carcinoma)」の用語を選択してはならない。
例示
3.13 内科的/外科的処置
SOC「外科および内科処置」の用語は通常AR/AEを表すことには適切でない。このSOCにリンクする用語は、複数軸構造をとっていない。ユーザーはこれらの用語を使用した際のデータ検索、データ解析、および報告への影響に注意すべきである。
処置の用語を選択する際は、以下のポイントを参考にされたい。
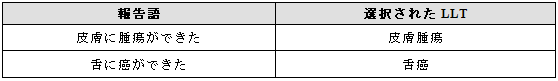
3.13.1 処置のみが報告された場合
処置に関する情報のみが報告された場合は、処置に対する用語を選択する。
例示
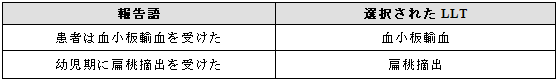
3.13.2 処置と診断が報告された場合
処置が、診断と組み合わされて報告された場合には、好ましい選択肢は処置と診断の双方の用語を選択することである。また、診断を示す用語のみを選択することも可能である。
例示

3.14 臨床検査
SOC 「臨床検査」には、検査の結果を表す修飾語(例:増加(increased)、低下(decreased)、異常(abnormal)、正常(normal))が付いている用語と修飾語が付いていない検査項目名を表す用語とが含まれている。「hyper-」、「hypo-」などの医学的状態に対応する用語は、その他の「疾患」のSOCに分類されている(例えば、SOC「代謝および栄養障害」)。
SOC「臨床検査」の用語は多軸に設定されていないため、データ検索に際して、特定の「疾患」のSOCに加えてSOC「 臨床検査」に関連する用語があるか否かを常に考慮しなければならない。
3.14.1 副作用/有害事象としての検査結果
検査結果の用語を選択する場合には、下記の点に留意が必要である。
Ø 医学的状態の用語あるは結果用語の選択
例示

Ø 曖昧でない検査結果
例示
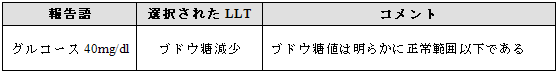
Ø 曖昧な検査結果
例示

3.14.2 診断と一致する検査結果
検査結果が診断名と共に報告され、両者が一致している場合には、診断名のみを用語選択して良い。
例示

3.14.3 診断と一致しない検査結果
検査結果が診断名と共に報告され、試験結果と診断名が一致しない場合には、診断名および診断名に一致しない検査結果の用語の双方を選択する。
例示

3.14.4 包括された検査結果
報告された個々の臨床検査の結果は、それぞれの用語を選択すべきである:包括された用語で報告されない限り、個々の検査結果を一つにまとめた用語を選択すべきでない。
例示

3.14.5 検査項目を表す用語
SOC「臨床検査」中の用語で修飾語を持たない用語は、診断のための検査データを入力する場合、臨床検査の項目名を記録するのに利用される(E2BのB.3.1.c)。
例示

「増加」などの修飾詞や数値(入手可能な場合)はE2B様式の「検査結果」の欄に入力する。
3.15 投薬・投与過誤と偶発的曝露
臨床的影響を伴うか否かにかかわらず投薬過誤に関する情報が報告されることがある。
MedDRAの手引書の付録Bにいくつかの投薬過誤の定義および使い方が記述されているので参照すること(例えば、調剤過誤)。
3.15.1 臨床的影響を伴う投薬過誤
投薬過誤が臨床的影響を伴って報告された場合には、投薬過誤と臨床的影響の双方の用語を選択する。
例示

3.15.2 臨床的影響を伴わない投薬過誤
臨床的影響を伴わない投薬過誤は、AR/AEではない。しかし、投薬過誤の発生またはその可能性を示唆する事象を捕捉することは重要である。投薬過誤の種類を表す用語で最も近いものを選択することが必要である。
また、報告者が副作用の発生がないことを報告している場合にはLLT「副作用なし」を選択することも可能である。
例示

3.15.3 偶発的曝露
同じ原則が偶発的曝露にも適用される。
例示

3.15.4 表示された相互作用と投薬過誤
添付文書に、特定の薬剤または食物との併用あるいは特定の疾患状態への投与により特定の影響があると記述されている場合には、下記にリストされている相互作用に関する投薬過誤の用語を選択する。

例示

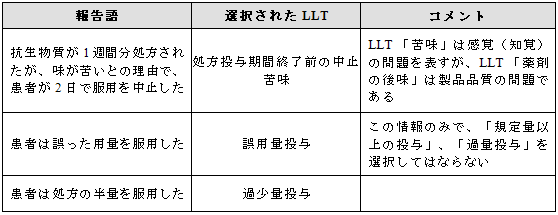
3.15.5 投薬過誤を推測しない
特定された報告がない限り、投薬過誤が発生したと推測しない。このことには規定量以上の投与、過量投与、過少量投与の発生も含まれる(3.17項目参照)。
例示
3.16 医薬品を介する感染因子の伝播
医薬品を介する感染因子の伝播が報告された場合、伝播(transmission)を表す用語を選択すること。さらに、感染が特定される場合には、追加用語として感染を特定する用語を選択すること。
例示
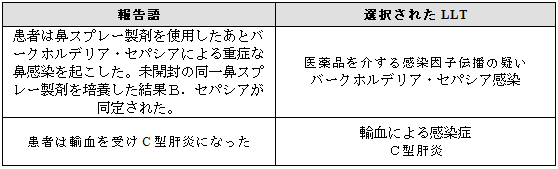
報告者は感染の伝播が医薬品によるものであると明確には報告していないが、その症例の他のデータから感染が示唆される場合には医学的な判断をするべきである。この場合、LLT「医薬品を介する感染因子伝播の疑い」という用語選択も可能であろう。同じ用語をE2Bの「送信者による診断名」の項目(B.5.3)に用いるべきである。
3.17 過量投与/毒性/中毒
過量投与の用語はHLT「過量投与」下にグルーピングされている。毒性と中毒の用語はHLT「中毒および毒性」の下にグルーピングされている。詳細な情報はMedDRAの手引書14.1(付録4.2項参照)を参照のこと。
例示
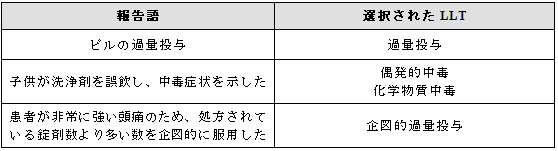
3.17.1 臨床的影響を伴う過量投与
過量投与に伴って報告された臨床的影響を表す用語と「過量投与」を選択する。
例示

3.17.2 臨床的影響を伴わない過量投与
過量投与が臨床的影響を伴わないと明確に報告された場合には、LLT「過量投与」とさらにLLT「 副作用なし」を選択することができる。 ( 3.20項参照)。
例示

3.18.1 臨床的影響を伴う医療機器に関連する事象
可能であれば、報告されている医療機器関連と臨床的影響の両方を反映する用語を選択する。
例示
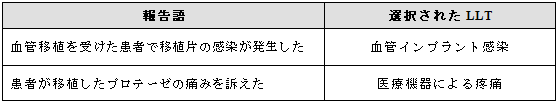
医療機器関連と臨床的影響の表す単一の用語がない場合は、双方の用語を選択する。
例示
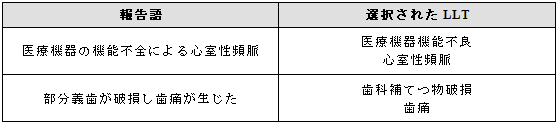
3.18.2 臨床的影響を伴わない医療機器に関連する事象
臨床的影響を伴わない医療機器関連の事象が報告された場合には、適切な用語を選択する。
例示
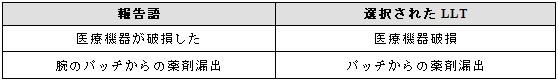
3.19 薬物相互作用
相互作用の用語には、薬物と他の薬物、食物、医療用具、アルコールとの間の相互作用が含まれている。この文書では薬剤には生物製剤も含まれている。
添付文書に明記された相互作用は投薬過誤に関連することがある(項目3.15.4参照)。
3.19.1 相互作用と特定された報告
相互作用の用語を選択し、さらに報告された医学的事象の用語を選択する。
例示

3.19.2 相互作用と特定されない報告
二つの製品が同時に使用され、報告者が特に相互作用の発生とは報告していない場合、医学的事象に対する用語のみを選択する。
例示

3.20.1 副作用なし
LLT「副作用なし」は、薬物に曝露されてもAR/AEが発生しなかったと明確に報告された場合のみに用いることができる(項目3.15.2 および項目3.17.2参照)。
3.20.2 「正常」用語
必要があれば、正常な状態および転帰の用語を利用することができる。

3.21 予期しない治療効果
薬剤が投与された目的とは異なるが、有益な効果をもたらした報告に対して、組織によってはLLT「予想外治療効果」として記録することが必要とされる場合があり得る。(このような効果は通常はAR/AEとは考えられない)
例示

3.22 効果の変化
効果の変化(増加、延長など)は常にAR/AEと見なされる訳ではないが、情報を記録することは重要である。
3.22.1 効果の欠如
効果の欠如による臨床的な影響が報告されているとしても、好ましい選択肢は“効果の欠如”の概念のみを選択することである。しかしながら、効果の欠如がもたらす事象の用語を選択することも可能である。
例示

例示

例示

3.23.1 社会環境用語の使い方
このSOC「社会環境」にリンクする用語は、社会的要因を表しており、社会環境歴や病歴データの入力に適している。SOC「社会的環境」に含まれる用語は、一般的にはAR/AEの入力には適切でない。しかし、ある種のAR/AEをコーディングするために、このSOCにリンクする用語のみが選択対象となることがあり、また、その用語が重要な臨床情報を追加することがある。
例示

SOC「社会的環境」に含まれる用語は多軸には設定されていない。またこのSOCは、MedDRAの他の障害を表すSOC(例えば、SOC「胃腸障害」)に含まれている用語とは異なり、医学的状態よりも、人(~者)を表している。
ユーザーはこれらの用語の使用がデータ検索、データ解析、報告に及ぼす影響を承知しておく必要がある。以下はその例示である。
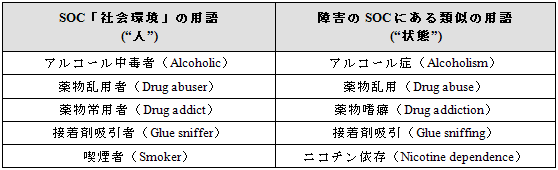
「abuse」は「薬物等の乱用」の概念の他に下表に示すように、人を表すか状態を表すかに関係なく「虐待」の概念にも使用される。この「虐待」に関する用語もSOC「社会環境」にあるので注意すべきである。
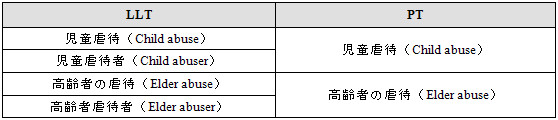
(次章 3.23.2を参照)
3.23.2 犯罪、虐待などの不法行為
犯罪あるいは虐待(医薬品あるいは物質の乱用を除く)の不法行為を表す用語はLLT「身体的暴行」のようにSOC「社会的環境」にリンクしている。
加害者を表すLLTは不法行為あるいは犯罪行為そのものを表すPTにリンクしている。
不法行為の被害者を表すPTは「~の被害者(Victim of ~)」と表記されている。
例示

例示

3.25 適応症
適応症は医学的状態、医学的状態の予防、補充療法、麻酔などの医学的処置あるいは“抗高血圧”のような逐語的表現で報告されることが考えられる。
例示
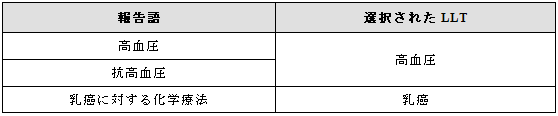
報告された内容が治療法のみであった場合は、最も特異的な用語を選択すする。
例示
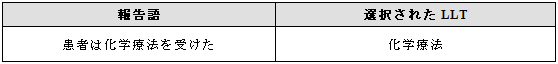
報告された適応症が医学的状態なのか、目的とする治療の効果なのか明らかでない場合がある。いずれの場合も選択された用語は同一になることがある。
例示

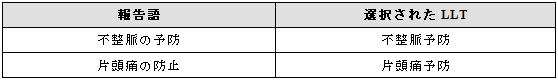
3.25.2 防止と予防
防止あるいは予防に関する適応症が報告された場合には、MedDRAの中に該当する用語があれば、それらを選択する(注:preventionとprophylaxisは、MedDRAでは同義語としている)。
例示
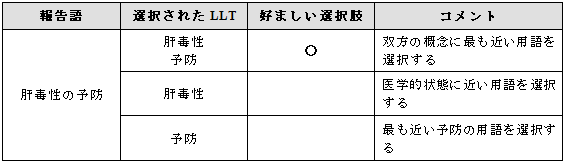
予防や防止を含んだ適切な用語がMedDRAにない場合は、下記の選択枝のいずれかを利用する(注:好ましい選択肢は一般的な防止/予防の用語と医学的状態に対する用語の双方を選択することである。
例示
3.25.3 処置、診断のための検査
薬剤が処置や診断のための検査に使用された場合には、適切な用語を選択する。
例示

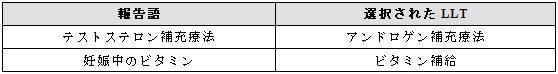
3.25.4 補給および補充療法
補給療法および補充療法に関する用語は、SOC「外科および内科処置」にある。(項目3.13参照) 薬剤の適応症が補給療法あるいは補充療法に相当する場合には最も近い意味の用語を選択する。
例示
3.25.5 適応症の報告なし
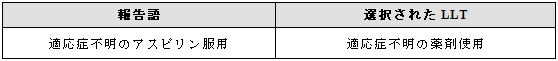
適応症が不明で、それ以上明確にできない場合には、「適応症不明の薬剤使用 (Drug use for unknown indication)」を選択することができる。
例示
3.26.1 適応症として報告された適応外使用
適応外使用(off label use )とは、医薬品を承認(表示)されていない適応症に使用することを言う。
ある医学的状態が使用目的として報告され、それが適応外使用であると明示されている場合には、好ましい選択肢はその医学的状態を表す用語を使用目的として選択することである。他の方法として、医学的状態/適応症とLLT「適応外使用」の双方の用語を選択することもできる。LLT「適応外使用(Off label use)」のみを選択するのはそれ以外に情報がない(使用目的が明示されていない)場合に限定される。
例示

例示

3.26.2 副作用/有害事象を伴って報告された適応外使用
副作用あるいは有害事象が未承認の適応症に使用された結果である場合には、好ましい選択肢は副作用あるいは有害事象を表す用語を選択することである。それとは別に、有害事象を表す用語と「適応外使用(Off label use)」の双方を選択することもできる。
例示

3.27 製品品質の問題
製品品質に関する問題は患者の安全性に関連を持つ可能性があるということを認識しておくことが重要である。それらは、有害事象との関連で、あるいは製品品質監視システムの一環として報告される可能性がある。
製品品質に関する問題は、製造/表示、包装、輸送、製品の取扱いあるいは保存の過程で引き起こされる異常な状態と定義される。これらは臨床的に影響を生じるかもしれないし、生じないかもしれない。こうした概念は用語選択にとっては難題であるかもしれない。
SOC「一般・全身障害および投与部位の状態」の下位のHLGT「製品品質に関する問題」にリンクしている用語を十分に理解しておくことが、これらの用語選択には必須である。このHLGTの下位にはHLT「製品包装に関する問題」、HLT「製品物性に関する問題」等の製品品質に関連した特別な分類がある。MedDRAの階層構造に従って適切なLLTまで下方展開(Navigating down)することが用語選択の最適な方法である。
特定の製品品質用語(例えば「製品コーティングの不完全」)の利用に関する説明はMedDRAの手引書の付録Bの「用語概念の記述」に記述されている。
3.27.1 臨床的影響を伴う製品品質の問題
製品品質に関連する問題が臨床的影響のある結果を持つ場合は、製品品質に関連する用語と臨床的影響に関する双方の用語が選択されるべきである。
例示

3.27.2 臨床的影響を伴わない製品品質の問題
臨床的影響がない場合でも製品品質に関連する問題の発生を捉えることは重要である。
例示

3.27.3 製品品質の問題と投薬過誤
製品品質に関連する問題と投薬過誤を識別することは重要である。
製品品質に関する問題は、製造/表示、包装、輸送、製品の取扱いあるいは保存の過程で引き起こされる異常な状態と定義される。これらは臨床的に影響する場合としない場合がある。
投薬過誤とは、薬剤が医療関係者、患者または消費者の管理下にある場合で、患者に有害なこと、または、薬剤の不適切な使用を引き起こすかもしれないすべての回避可能な出来事と定義される。
製品品質問題の用語に関連する説明はMedDRAの手引書の付録Bの「用語概念の記述」に記述してある。
例示

4.1.1 バージョン管理の方法
MedDRA利用のそれぞれの組織はバージョン管理の戦略を策定すべきで、それは文書化されなければならない。バージョン管理戦略は安全性データベースと臨床試験データベースで異なることもある。例えば、臨床試験では、古い臨床試験で現在利用しておらず、将来も利用しないデータについてはバージョン更新の必要がないことも考えられる。一方、市販後の安全性データは最新(あるいはそれに近い)バージョンで報告することが要求され、バージョン更新の推奨が実施されるべきである。
ユーザーはそれぞれの組織の性格に基づき、最も適した方法を選択すべきである。下記に示したいくつかの方法(オプション)は、それぞれの利用組織が新しいバージョンの導入に際して利用できる事例を示したものである。これらの方法は規制上の要件と理解すべきではないが、組織内あるいは組織間の効果的なコミュニケーションに有効に利用すべきである。
下記の図は新バージョン適用のいくつかのタイプをまとめたものである。
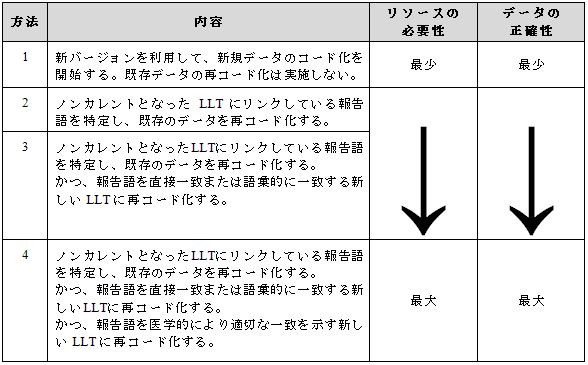
ここに示した例がすべてではない。これ以外の新規バージョンの導入方法もあり得る。データベースにどのようにMedDRAデータが格納されているかによっては、データの検索と報告の整合性を確保するために追加の方法が必要かも知れない。その中にはバージョン更新の実施後に医学的評価を実施することも含まれる。
方法4はリソースを最も必要とし、方法1は最少であることに留意されたい。その他の考慮すべき事項は、新たに直接一致あるいは正確な概念を示すLLTを選択すること(方法4)は他の方法と比較して最も正確なデータを提供することになる。4.1.2 新バージョン導入のタイミング
個別症例報告の場合は、情報の発信する側と受信する側のMedDRAのバージョンが同一のものである必要がある。この新バージョンの導入のタイミングに関する個別症例報告および臨床試験データについてMSSOの推奨文書が公表されており(付録4.2項参照)、その概要は下記のとおりである。

Document |
Link |
ICH国際医薬用語集手引書 |
http://www.pmrj.jp/jmo/ 会員へのお知らせ-ドキュメントライブラリー |
MedDRA用語の追加変更要請について |
http://www.pmrj.jp/jmo/ |
オンラインMedDRA/J検索ツール |
|
MedDRA/J Browser |
http://www.pmrj.jp/jmo/ |
改訂情報(バージョンごと) |
http://www.pmrj.jp/jmo/ |
個別症例データのバージョン管理に関するMSSOの勧告文書 |
http://www.pmrj.jp/jmo/ |
臨床試験データのバージョン管理に関するMSSOの勧告文書 |
http://www.pmrj.jp/jmo/ |
いずれのJMOのサイトへのアクセスにはID/PWが必要です。
* 現在のラポーター(共同)
** 2010年6月のWG会議での臨時ラポーター
* 過去のラポーター